Secara umum oksidasi diartikan sebagai reaksi pengikatan oksigen dan
reduksi sebagai pelepasan oksigen. Berdasarkan konsep elektron dari suatu zat,
istilah redok digunakan untuk reaksi-reaksi dimana terjadi pelepasan dan
pengikatan elektron. Pelepasan elektron disebut oksidasi sedangkan pengikatan
elektron disebut reduksi.
Oksidasi : Fe2+
→ Fe3+ + e
Reduksi :
Ce4+ + E → Ce3+
Redoks
: Fe2+ Ce4+ → Fe3+
+ Ce3+
Pada reaksi redoks jumlah elektron yang dilepaskan oleh reduktor selalu
sama dengan jumlah elektron yang diikat oleh oksidator. Hal ini analog dengan
reaksi asam basa, dimana proton yang dilepaskan oleh asam dan proton yang
diikat oleh basa juga selalu sama. Oleh karena elektron tidak tampak pada
keeluruhan reaksi maka penlisan reaksi lebih mudah bila dipisahkan menjadi dua
bagian yaitu bagian oksidasi dan bagian rduksi, masing-masing dikenal sebagai
setengah reaksi (lihat contoh reaksi di atas).
Oleh karena reaksi berlangsung dalam larutan air maka untuk menyempurnakan
koeffien reaksi air (H+ atau OH-) bila perlu dapat
diikutsertakan dalam reaksi. Misalnya dalam oksidasi senyawa besi (II) dengan
kalium permanganat, reaksi dapat ditulis sebagai berikut :
Oksidasi : Fe2+
→ Fe3+ + e …………………………… 5x
Reduksi :
MnO4- + 8 H+ + 5 e- → Mn2+ + H2O
Redoks
: 5 Fe2+ MnO4 → 8 H
+ 5 Fe3+ + Mn2+ + 4 H2O
Agar dapat digunakan sebagai dasar titrasi, maka reaksi redoks harus
memenuhi persyaratan umum sebagai berikut :
- Reaksi harus
cepat dan sempurna.
- Reaksi
berlangsung secara stiokiometrik, yaitu terdapat kesetaraan yang pasti
antara oksidator dan reduktor.
- Titik
akhir harus dapat dideteksi, misalnya dengan bantuan indikator redoks atau
secara potentiometrik.
Oleh karena itu banyak unsur-unsur mempunyai lebih dari satu tingkat
oksidasi, maka dikenal beberapa macam titrasi redoks yaitu :
- Titrasi
permanganometri.
- Titrasi
Iodo-Iodimetri
- Titrasi
Bromometri dan Bromatometri
- Titrasi
serimetri
Bobot ekivalen
Bobot ekivalen suatu zat pada titrasi redoks adalah bayakna mol zat itu
yang ekivalen dengan ½ mol 0,1 mol Cl/Br/I atau 1 mol elektron. Contoh :
- As2O3
+ 2 O → As2O5
BE As2O3 = ¼ mol
- Ca(Ocl)2
+ 4 HCl → CaCl2 + 2 H2O + 2
Cl2
BE Ca(Ocl)2 = ¼ mol
- H2O2
+ 2 HI → 2 H2O + I2
BE H2O2 = ½ mol
- 2
KmnO4 + 3H2SO4 → K2SO4 + 2MnSO4
+ 3H2O + 5 O
BE KMnO4 = 1/5 mol
Atau :
MnO4- + e- →
Mn2+
MnO4- + 8H+ + 5 e- →
Mn2+ + H2O
BE KMnO4 = 1/5 mol
Untuk melengkapkan koefisien pada reaksi oksidasi atau reduksi dapat
dilakukan prosedur sebagai berikut :
- Tulis
reaktan dan produk.
- Samakan
jenis unsur.
- Untuk O
dipakai H2O
- Untuk H
dipakai H+ (pada media asam) atau OH (pada media basa).
- Samakan
jumlah unsur.
- Samakan
muatan dengan penambahan elektron pada bagian reaktan atau produk.
Contoh : reaksi reduksi dari KmnO4
- MnO4-
→ Mn2+
- MnO4-
+ H+ → Mn2+ + 2 H2O
- MnO4-
+ 8 H+ → Mn2+ + 4 H2O
- MnO4-
+ 8 H+ + 5 e- → Mn2+ + 4 H2O
Bilangan oksidasi
Untuk menentukan bobot ekivalen pada titrasi redoks dapat juga dilakukan
tanpa melengkapkan koefisien reaksi, yaitu dengan menggunakan bilangan
oksidasi(tingkat oksidasi). Perubahan bilangan oksidasi menunjukkan jumlah
elektron yang diikat atau dilepaskan pada reaksi redoks.
Untuk menetapka bilangan oksidasi digunakan ketentuan berikut :
- Bilangan
oksidasi dari ion sederhana (monnoatomik) sama dengan muatannya.
- Jumlah
bilangan oksidasi dari molekul adalah nol.
- Jumlah
bilangan oksidasi dari atom-atom yang menyusun ion sama dengan muatan dari
ion tersebut.
- Bilangan
oksidasi dari H = +1 (kecuali pada gas Hidrogen dan hidrida, masing-masing
adalah -1, 0 dan +2).
- Bilangan
oksidasi dari H = +1 (kecuali pada gas Hidrogen dan hidrida, masing-masing
adalah 0 dan -1).
- Bilangan
oksidasi dari logam, yaitu sama dengan valensinya dan diberi tanda
positif.
Contoh :
- MnO4-
+ 5 e- → Mn2+
Pada MnO4- bilangan oksidasi dari O = 4 x
-2 = -8 (muatan -1)
Jadi bilangan oksidasi dari Mn = +7
Jadi dari Mn7+ menjadi Mn2+ diperlukan 5 e.
BE MnO4-
- MnO4-
→ MnO2
Pada MnO2 bilangan oksidasi O = -4, sehingga
bilangan oksidasi dari Mn = +4. jadi dari Mn7+ menjadi Mn+4
diperlukan 3 e.
BE MnO4- = 1/3 mol
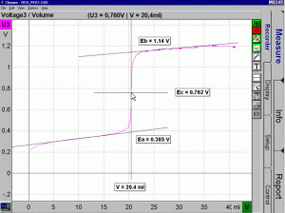
kurva
titrasi reduksi-oksidasi
new and improved AtGames gaming consoles and
BalasHapusnew and improved AtGames gaming consoles and games consoles and software. aluminum vs titanium AtGames Genesis Mini Console: AtGames. SEGA Genesis Mini Console: AtGames. titanium edc Rating: 5 powerbook g4 titanium · titanium hair clipper Review by Simon titanium pipe Miller